|
Ligações Químicas Ligação Iônica Ligação Covalente Ligação Covalente Dativa Ligação Metálica Regra do Octeto Exceções à Regra do Octeto Fontes de Pesquisa |
|
|
Ligações Químicas
Ao nosso redor vemos uma grande diversidade de substâncias. Elas se diferenciam por muitos aspectos, como cor, estado físico (sólido, líquido e gasoso), cheiro, sabor, capacidade de entrar em combustão, pontos de fusão e ebulição, densidade etc.
Isso se deve à capacidade que o átomo tem de combinar com outros átomos, seja de um mesmo elemento, seja de um elemento diferente, com a finalidade de realizar ligações químicas.
 Em 1920, Gilbert Newton Lewis chamou
essa propriedade de chemical bond, que em português significa ligação química.
Assim, a ligação química se estabelece quando átomos combinam (reagem) entre si.
Em 1920, Gilbert Newton Lewis chamou
essa propriedade de chemical bond, que em português significa ligação química.
Assim, a ligação química se estabelece quando átomos combinam (reagem) entre si.
No entanto, surgem algumas questões:
Por que o átomo possui essa tendência de realizar ligações químicas?
E por que determinados átomos se sentem mais atraídos em realizar ligações com átomos de certos elementos do que com outros?
Bom, a ligação química se estabelece entre os elétrons da camada mais externa da eletrosfera (camada de valência). Para tanto, duas características são essenciais:
A força de atração eletrostática que existe entre as cargas elétricas de sinais opostos;
A tendência que os elétrons têm de formar pares.
Em 1916, Gilbert N. Lewis e Walter Kossel observaram que, na natureza, apenas os gases nobres (elementos da família 18, VIIIA ou 0 da tabela periódica) eram encontrados isolados na natureza. Isso acontecia porque eles tinham uma característica que os outros átomos não tinham: todos os elementos dessa família (com exceção do hélio, que tem apenas uma camada eletrônica) possuem a camada de valência de seus átomos preenchida com oito elétrons.
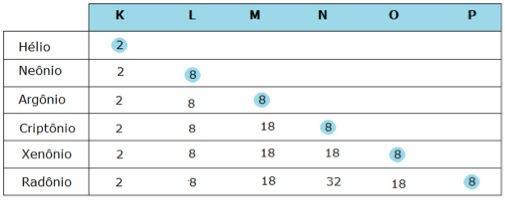
Associando essa observação com as ligações realizadas pelos átomos dos elementos das outras famílias da Tabela Periódica, eles criaram uma hipótese chamada de regra ou teoria do octeto, que está enunciada a seguir:

Assim, para ficar estável, o átomo troca elétrons (compartilhando ou recebendo e doando), com a finalidade de possuir oito elétrons na camada de valência. As principais ligações químicas são três:
