|
Ligações Químicas Ligação Iônica Ligação Covalente Ligação Covalente Dativa Ligação Metálica Regra do Octeto Exceções à Regra do Octeto Fontes de Pesquisa |
|
|
Ligação Covalente
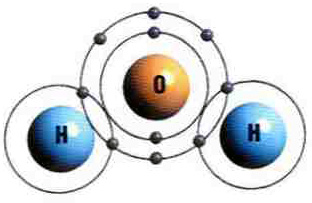
A ligação covalente é um tipo de ligação química realizada entre os átomos de hidrogênio, ametais e semimetais que compartilham entre si pares de elétrons.
 |
 |
|
Molécula de água |
O dióxido de carbono é formado por ligações covalentes entre o carbono e dois átomos de oxigênio |
A ligação covalente é um tipo de ligação química que ocorre com o compartilhamento de pares de elétrons entre átomos que podem ser o hidrogênio, ametais ou semimetais.
Segundo a teoria ou regra do octeto, os átomos dos elementos ficam estáveis quando atingem a configuração eletrônica de um gás nobre, ou seja, quando eles possuem oito elétrons em sua camada de valência (camada mais externa) ou dois elétrons — no caso de possuírem somente a camada eletrônica K.
Assim, seguindo essa regra, os átomos dos elementos mencionados possuem a tendência de ganhar elétrons para alcançarem a estabilidade. Por exemplo, o hidrogênio no estado fundamental possui somente um elétron na sua camada eletrônica; assim, para ficar estável, ele precisar receber mais um elétron de outro átomo.
Se tivermos dois átomos de hidrogênio, ambos precisarão receber um elétron cada. Por isso, em vez de transferirem elétrons (como ocorre na ligação iônica), eles farão uma ligação covalente em que compartilharão um par de elétrons. Desse modo, ambos ficarão com dois elétrons, adquirindo a estabilidade:
|
|
| Ligação covalente de formação do gás hidrogênio |

Essa forma de representar as ligações químicas, em que os elétrons da camada de valência são colocados ao redor do símbolo do elemento como “pontinhos”, é chamada de fórmula eletrônica de Lewis. Nela, cada par de elétrons compartilhado em uma ligação covalente é representado por um “enlaçamento” entre os dois pontinhos.
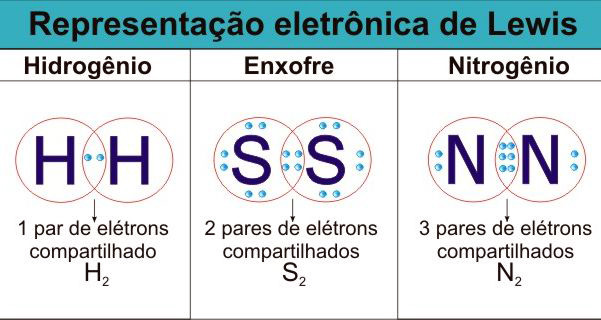
Existe outra forma de representar as ligações covalentes, que é por meio da fórmula estrutural. Nessa fórmula, cada par compartilhado é representado por um traço. Veja:
 |
| Representação das ligações covalentes em fórmulas estruturais |
Assim, a ligação que forma o gás hidrogênio é representada da seguinte forma: H─H. E sua fórmula molecular é H2.
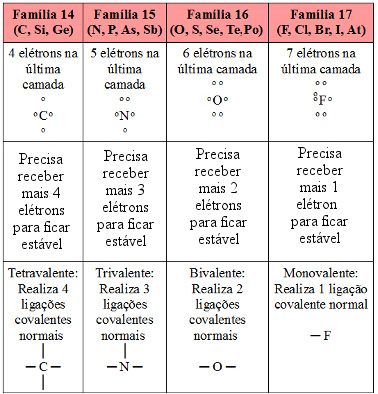
Visto que o hidrogênio é capaz de realizar somente uma ligação covalente, dizemos que ele é monovalente. Veja na tabela a seguir a quantidade de ligações covalentes que os principais ametais e semimetais podem realizar:
 |
|
Possibilidades de realização de ligação covalente dos ametais e semimetais principais da Tabela Periódica |
Com base nisso, consideremos agora a molécula de dióxido de carbono (CO2). O carbono, que pertence à família 14, possui quatro elétrons na última camada, como mostrado na tabela, e precisa fazer quatro ligações covalentes para ficar estável. Já o oxigênio é da família 16, possui seis elétrons na camada de valência e precisa realizar duas ligações. Desse modo, o carbono compartilha dois pares de elétrons ou faz duas ligações duplas com cada átomo de oxigênio. Veja como ficam as fórmulas eletrônica e estrutural, respectivamente, do dióxido de carbono:
|
|
| Fórmula eletrônica e estrutural do dióxido de carbono |
Veja mais exemplos a seguir:
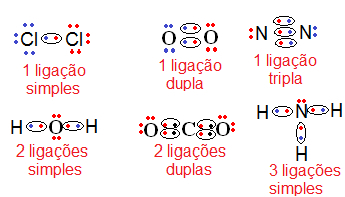 |
| Exemplos de ligações covalentes (fórmulas eletrônicas) |
Mas existe um tipo especial de ligação covalente, a Ligação Covalente Dativa.