|
Ligações Químicas Ligação Iônica Ligação Covalente Ligação Covalente Dativa Ligação Metálica Regra do Octeto Exceções à Regra do Octeto Fontes de Pesquisa |
|
|
Ligação Iônica
A ligação iônica é formada pela atração eletrostática entre íons de cargas opostas, positivos (cátions) e negativos (ânions). Nesta ligação a transferência de elétrons é definitiva.
A ligação iônica ocorre quando um elemento metálico reage com um ametálico. Os metais doam seus elétrons de última camada, esses serão recebidos pelos ametais. Vejamos como:
- Metais que possuem 1, 2, ou 3 elétrons na última camada se ligam com ametais que possuem 5, 6 ou 7 elétrons.
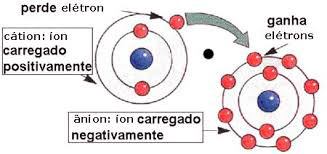
- Para formar a ligação iônica é necessário que um dos átomos possua uma tendência de ceder elétrons, enquanto outro tenha a tendência de receber elétrons. Os átomos com tendência a ceder elétrons são os metais das famílias IA, IIA, IIIA, e os átomos que recebem elétrons são os ametais que apresentam quatro, cinco, seis e sete elétrons na camada de valência.
Como se formam compostos iônicos?
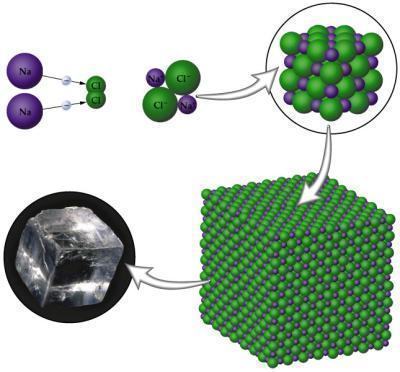
- Arranjos entre compostos iônicos formam substâncias iônicas. Tudo começa quando os íons unem-se devido às forças de atração eletrostática. Se observarmos por um microscópio, perceberemos a formação de retículos cristalinos, que são aglomerados de íons de forma geométrica bem definida.
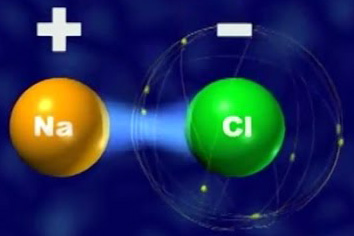
- Os sais e outros grupos de minerais possuem íons que formam compostos iônicos e, consequentemente, substâncias iônicas. A formação do sal de cozinha (cloreto de sódio) a partir de átomos de sódio (Na) e de cloro (Cl) é o exemplo que mais representa uma ligação iônica. O átomo de sódio consegue a estabilidade eletrônica quando perde um elétron, originando o íon Na+. O átomo de cloro atinge a estabilidade quando recebe um elétron, originando o íon Cl-.
Os compostos constituídos pelos íons (Na+ e Cl-) são designados compostos iônicos, por serem eletronicamente estáveis, ou seja, ocorre uma interação eletrostática entre eles (cargas com sinal contrário se atraem):
Na+ + Cl- → NaCl
|
|
Os compostos iônicos em geral apresentam altos pontos de fusão e ebulição, são sólidos duros e quebradiços e solubilizam-se facilmente em solventes polares.