|
Ligações Químicas Ligação Iônica Ligação Covalente Ligação Covalente Dativa Ligação Metálica Regra do Octeto Exceções à Regra do Octeto Fontes de Pesquisa |
|
|
Exceções à Regra do Octeto
 |
|
O trihidreto de boro é uma exceção à regra do octeto, pois o boro possui apenas seis elétrons em sua camada de valência |
A teoria eletrônica da valência,
criada em 1916, pelos cientistas Gilbert N. Lewis e Walter Kossel, mais
conhecida como Regra do Octeto, diz o seguinte:

Assim, ao realizarem ligações entre si, independentemente do tipo de ligação (iônica, covalente ou metálica), os átomos envolvidos perdem, ganham ou compartilham elétrons com a finalidade de adquirir esse octeto eletrônico, ou seja, de ficar com oito elétrons na camada de valência e atingir a configuração de gás nobre.
Entretanto, na prática, existem exceções a essa regra, pois alguns elementos ficam estáveis com menos de oito elétrons e outros com mais. Além disso, ainda há alguns que se estabilizam com um número ímpar de elétrons. Vejamos alguns exemplos:
Contração do octeto (Estáveis com menos de oito elétrons):
Ocorrem nos elementos do segundo período em diante, principalmente nas moléculas que apresentam o berílio e o boro, além também de alguns óxidos de nitrogênio. Abaixo temos dois casos assim:
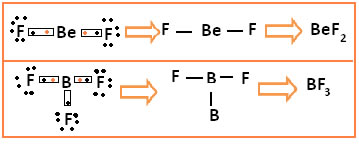
No primeiro caso temos o difluoreto de berílio. Note que apenas com duas ligações, isto é, com 4 elétrons na camada de valência, o berílio já atinge a estabilidade eletrônica.
Já no segundo caso, no trifluoreto de boro, o boro adquire estabilidade compartilhando seus três elétrons de valência com três átomos de flúor, assim ele fica estável com apenas 6 elétrons na camada de valência.
Em ambos os casos os átomos do flúor ficam com o octeto completo, mas o elemento central não.
Expansão do Octeto (estáveis com mais de oito elétrons):
Esse caso ocorre em elementos do terceiro período em diante, pois, visto que são mais de oito elétrons que terão que se comportar na camada de valência, o átomo precisa ser relativamente grande. É por isso que os elementos do segundo período nunca se expandem. Os elementos principais nos quais essa expansão do octeto ocorre são o fósforo (P) e o enxofre (S):
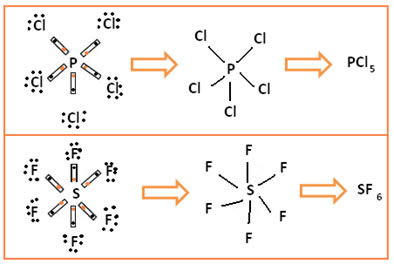
No primeiro caso, o fósforo ficou estável com 10 elétrons em sua camada de valência; já no segundo exemplo, o enxofre ficou com 12 elétrons.
Isso pode ocorrer também em compostos de gases nobres formados em laboratório, como o XeF2 e o XeF4.
Estáveis com um número ímpar de elétrons:
São poucos os elementos em que isso ocorre, mas os mais comuns são os radicais livres NO, NO2 e ClO2, em que os elétrons na camada de valência dos átomos centrais são apenas 7. Veja um desses casos:
